Your cart is currently empty!
Category: 威士忌の科学
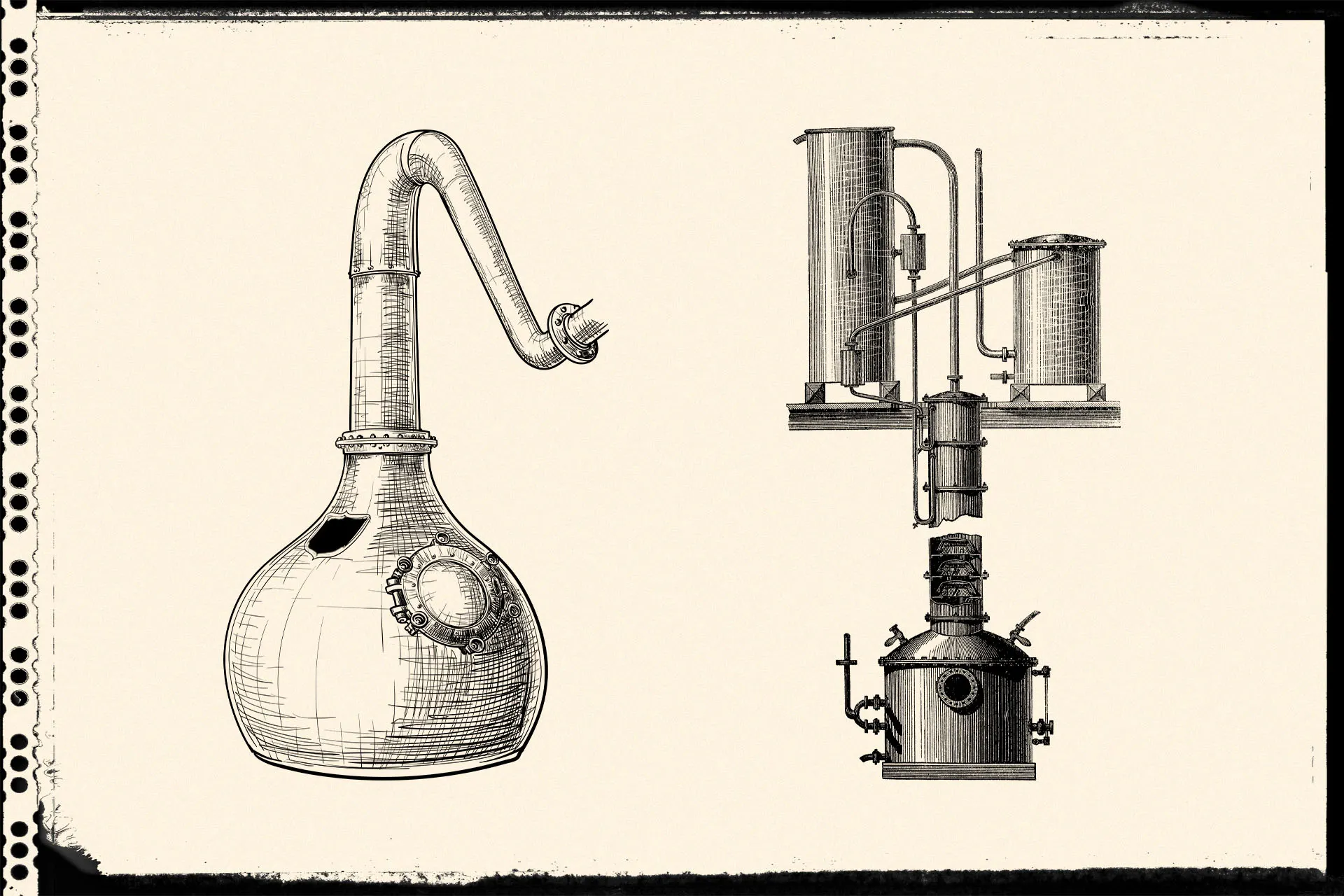
威士忌蒸馏原理与蒸馏器简介
文章中威友们最不熟悉的应该算是第三种设置:柱式批次蒸馏,原因很简单,就是我们熟悉的苏格兰威士忌酒厂没有一间是使用这种蒸馏设置的。Heriot-watt 学校的蒸馏室有一座这种蒸馏器,而这种蒸馏器的优点是不用太高大就可做出酒精度较高的酒,而且速度也快很多。按我的理解这种蒸馏器在苏格兰有两个缺点:(一)若用来蒸馏谷物威士忌的话,不能连续蒸馏会大大增加成本,经济上未必有着数;(二)若用来蒸馏麦芽威士忌的话,应该会被SWA骂说这不算是一种“pot still”,尽管法规上好像没有为何谓pot still作一个清晰的法律定义。 —— Mr. J Whiskiology 在制作苏格兰威士忌时,无论是麦芽威士忌或是谷物威士忌,肯定都少不了”蒸馏”这个步骤。蒸馏几乎可说是制造各式烈酒的最常见方式,因为借由蒸馏可以很容易得将酒精度提升。但是为什么蒸馏可以达到提高酒精度的效果呢?以下将做个简单介绍: 蒸馏是一种将混合物中不同物质分离的方法之一。将某混合液加热后,该混合液会开始沸腾,此时混合液所产生的气体中,较容易挥发的物质比例会较在原混合液中高。将这些气体收集起来再冷却成液体后,这些液体中较容易挥发的物质比例当然就会比在原混合液中高。 举苏格兰麦芽威士忌蒸馏的例子来说,发酵完的酒汁若只观察其中含量最多的两样物质(水与乙醇)并忽略掉其他化合物,可视为单纯将乙醇与水混和的混合液。假设该混合液中乙醇与水的体积比为8%(亦即酒精度为8% abv),拿去在一大气压的情况下做蒸馏时,大约加热至94.5度C时会开始沸腾产生大量气体。若我们将开开始沸腾时产生的这些气体收集并冷凝成蒸馏液,我们会发现这些蒸馏液的酒精浓度大约是45% abv。由于我们从原本8% abv的酒汁中拿走了一些45% abv的成分,所以酒汁的酒精度会稍微下降,接着蒸馏下去所产生的蒸馏液酒精度也会稍微小于45% abv。持续蒸馏时酒汁的温度会逐渐提高,而收得的蒸馏液浓度会逐渐降低,通常来说第一次蒸馏会持续到收得的蒸馏液降到1%左右才停止,此时酒汁中的酒精浓度大概也剩0.1%左右了,继续蒸馏下去有点浪费能源,所以这些剩下的酒汁废液(称为pot ale)会被排出蒸馏器,接着准备进行下一轮蒸馏。 在以上的蒸馏过程中,我们会发现几件事情: 1. 两种不同沸点的物质混合形成的液体,若这混合液中的两物质都可挥发,且A沸点较低(例如乙醇,一大气压时沸点78.4度C),B沸点较高(例如水,一大气压时沸点100度C),则当加热到温度达A的沸点(78.4度C)时,不会发生混合液中A开始蒸发而B完全留在液体中的情况。事实上,该混合物会因两物质的比例不同,导致加热到A的沸点时该混合物还不会沸腾。如上例,酒精度为8% abv的乙醇与水混合液必须加热94.5度C时才会开始沸腾。而当该混合物开始沸腾时,此时产生的气体是A与B混合在一起的气体(上例中冷凝后酒精度是45% abv的气体),且这些气体中A与B的比例会比还未蒸发的液体(酒精度8% abv)中A与B的比例还高,也就是说蒸馏液中A的浓度被提升了。 2. 蒸馏时,容器内的液态混合物会产生蒸气,这些蒸气造成的压力称为蒸气压,温度越高则蒸气压越高,当蒸气压等于大气压力时我们会说混合液开始沸腾了。由于上面的例子中体积比8%的酒精产生的蒸气压跟体积比92%的水在94.5度C左右时合作产生的蒸气压大概是一个大气压力,所以我们说他在94.5度C时会开始沸腾,这个温度点被称为泡点(bubble point),也有人直接叫他沸点(在混合溶液中讲沸点溶液混淆,而且也不知道是在讲哪个物质的沸点,所以我还是习惯称之为泡点)。 3. 理论上我们如果在一大气压下将8% abv的酒汁只简单蒸馏一次,其蒸馏液的酒精度很难超过45% abv(因为A物质的浓度在刚沸腾时的蒸汽中最高,接着会越来越低),若要继续提升只能把这些蒸馏液收集起来再拿去做第二次蒸馏。 上述乙醇与水的例子是用大家比较熟悉的体积浓度来做解释,但由于体积浓度容易随温度而改变,例如在夏天高达35度C的室内把40% abv (通常此数值是在20度C的情况下测得的) 的威士忌拿去用比重计测酒精度时,你会发现测出来的酒精度变成将近45% abv了。所以实际在应用上时会比较常使用莫耳浓度(% mol)而非体积浓度来做计算。 以上的概念若正确的话,接着讨论蒸馏的计算就会比较容易理解了。 蒸馏的原理是利用混合物中各物质在固定温度下,其饱和蒸气压不同而达成的。若在某个温度下A的饱和蒸汽压比B的高,这代表该温度下A会比B容易挥发,也就是A产生的气体较多,因此A气体造成的压力(蒸气压)较大。假设这两种物质可形成理想溶液,且我们在定温定压下某容器中发现A与B的液体莫耳数比为1:1,但是他们产生的气体中莫耳数比是2:1,这样我们会说A的挥发度比B高,而A比B的相对挥发度(relative volatility,通常写作αAB)就是2,也就是说A的挥发能力是B的两倍。那如果这两物质在混合液中的莫耳数比不是1:1的话怎么办呢? 先假设C与D两物质在定温定压时的饱和蒸汽压完全一样,也就是C与D的相对挥发度相同。若这两物质可形成理想溶液,当这两物质以不同莫耳数混合时,我们会发现他们产生的气体莫耳数比会跟他们液体中的莫耳数比相同,也就是说拿3莫耳的C与2莫耳的D混合时,他们产生的气体中C与D的莫耳数比是3:2。从这个例子告诉中可看出来,两相对挥发度相同的物质在气体中的莫耳数比会跟他们在液体中的莫耳数比相同。 那如果是相对挥发度不同的A与B两物质以不同莫耳数形成理想溶液的话,他们在气体中的莫耳数比会如何改变呢?假设A与B的相对挥发度αAB是2,但他们在液体中的莫耳数比是1:4 (也就是1份的A与4份的B),那么因为A的挥发能力是B的两倍,所以A即使在液体中只有1份,它也会产生1*2份的A气体,而B在液体中虽有8份,但他只能产生8*1份的气体,所以此时A与B产生的气体莫耳数比是1*2 : 8*1,也就是1:4。 由上面的例子可知道,我们若想知道两物质在定温定压下的相对挥发度αAB,可以利用 αAB = (A在气相中的莫耳数 / A在液相中的莫耳数) / (B在气相中的莫耳数 / B在液相中的莫耳数) 来求得。 其实只要把(A在气相中的莫耳数 / A在液相中的莫耳数)想成A的挥发能力,这样这个算式就比较容易理解了。 到这边我们可以先暂时下个简单的结论:若A的相对挥发性较高,那么A与B的混合溶液经过蒸馏后产生的蒸气中,A的浓度会比原来高(蒸气中的B浓度当然也就比原来低);留下来未蒸发的液体中因为较多的A被取走,所以这些废液中A的浓度会比原来低(废液中的B浓度当然也就比原来高)。因此我们可以借由蒸馏将挥发能力不同的物质分离。 但这边有两点要注意: 1. 两物质的相对挥发度并非一成不变,而是可能随着两物质在液体中的比例、温度与压力而改变。例如体积比为97.2% abv的乙醇与水混合物会在78.2度C时沸腾,但此时他们的相对挥发度是1,代表该该混合物就算拿去蒸馏,蒸馏出来的气体冷凝后也只会是97.2% abv的乙醇溶液,根本是白做工。…

谈谈威士忌的风土「Terroir」
风土(Terroir)”一词来自葡萄酒界,由于各产区、庄园所在位置不同,当地的地形、地质、土壤、风向、日照、气温、降雨量及降雨频率等因素,以及种植、采收葡萄的人,都将影响葡萄的生长和酒的酿造,这种种因素的总合统称为风土。对威士忌而言,过去我们惯称的五大产国,或是苏格兰细分的五大(或六大)产区,似乎暗示着不同产国、产区可制作出各具代表的风味特色。 当苏格兰的威士忌公司想要找一个方式,说明苏格兰各地都在生产威士忌时,风土就被包覆在地域性的概念之中。这个出发点是好的,问题是它经不起检视。这些地域性界线并不是地理上的,而是政治上的。各地区的范围也过于广大,我们真的要相信在高地区(Highlands),从格拉斯哥市(Glasgow)郊外到奥克尼群岛(Orkney)的每一款威士忌喝起来都是一样的?达夫镇(Dufftown)的每款烈酒味道也都一样吗?不一样。难道威廉· 格兰特(William Grant)在这个镇上拥有的三家蒸馏厂,出产的每款威士忌味道都一样吗?当然不一样! “Terroir” is a geographical-entity that helps differentiate “this” from “the others”,所讲的就是一个地方的“天”、“地”、“人”。 “天”,指的是气候,例如温湿度、降雨、阳光、风向和风力等。 “地”,指地势和土壤,像高度、坡度和坡向、土壤成份、疏水性、邻近动植物等。 “人”,指知识、技能、创造力、选择、承传和创新等。 「风土」一事近日来在网络上被重新谈起,事源爱尔兰新酒厂Waterford在推出它们第一batch的威士忌时将重心放了在强调风土之上,甚至乎写了如〈War on Terroir〉等一系列的文章向业界叫阵。正所谓有讨论才有进步,对于Waterford的勇气笔者是肯定的,至于有勇又是否等同有理呢?让我们一同来思考一下。 不论葡萄酒或威士忌,最重要的其实都是“人”。包括Waterford此长文在内,似乎很多人在论及风土的时候,都无意地忽略了人的重要性,而将风土单界定为“天地”使然,我认为并不准确。 不同大麦品种所制的new make会否有不同风味? Yes, of course. 布莱迪(Bruichladdich)的首席调酒师Jim McEwan在产业超过五十年,从未离开艾雷岛,对于苏格兰、艾雷岛有着狂烈执着的热爱,因此酒厂使用的大麦全种植于苏格兰,更与艾雷岛农夫签约契作,复育了从一次大战以后几乎消失的艾雷岛大麦。包括分别以苏格兰大麦和艾雷岛大麦制作出来的新酒、基本无年份款、波夏(Port-Charlotte)以及超高泥煤度的奥特摩(Octomore)。各组的酒龄、制程条件类似,但不同大麦呈现的风味却明显有分,尤其是少了橡木桶干扰的新酒,可清楚辨识较为轻柔果味的苏格兰大麦,以及具有清新有力且略带海潮咸味的艾雷岛大麦。Jim McEwan解释,由于艾雷岛近海,海水盐份免不了入渗土壤,加上凛冽的海风吹袭,大麦生长环境不良,扎根必须够深且麦茎必须够壮,当然和苏格兰本土大麦有所不同。 不同气候下所种的同一品种大麦会否产生不同风味?Yes, of course. Yes, of course. 至于格兰杰的首席调酒师Dr. Lumsden,从穿着白袍的技术背景跨入业界,充满创意和实验精神,过去向以换桶熟成技术知名于世。所发表的Tusail酒款,使用的是五十年前广受欢迎,但因酒精出产率偏低而没落、甚至面临绝种危机的冬季大麦。由于淀粉质及蛋白质的含量比例有异于普遍使用的春季大麦,因此拿来与相同制程的格兰杰“经典”对照,其基调并未脱离以花果甜为主的酒厂风格,却罕见的呈现具有厚度的油脂与土地质感,一扫轻柔纤细的刻版印象。 这样就等于“证明”了有所谓的威士忌风土吗? Sorry, the answer is no. 我们知道威士忌有多种工序,由发麦方式、磨麦比例、糖化温度、发酵时间、酵母选择、蒸馏器大小形状高矮、蒸馏速度、冷凝器类型等等等等全部都可以影响威士忌的风味,即若有别地的蒸馏厂取了Waterford的大麦,完美复制它的造酒设备,理论上是可以做出一样的威士忌,那么我们又要说这所别地的蒸馏厂有一样的风土吗?似乎不焉。特别是当我们调整了上述制程工序的一小环,其实也有机会大大影响newmake的最终风格,我已经不讲大大的木桶影响了。 今日的威士忌产业已经高度分工,各蒸馏厂除了水源必须就近引用之外,麦芽由商业发麦厂采购世界各地的大麦来制作,酵母菌由专业扩培厂提供,这些原料送到酒厂之后,采用自动化设备日以继夜地产制,而后再由橡木桶决定绝大部分的风味。利用精密分工和精确控制的流程,可榨取出每一颗麦芽中最后一滴酒精,进而改变成本结构,让威士忌行销全世界,但同时也远离农业,更难与“风土”扯上关系。 让多少“天地”的风土留到最后,终归是“造酒人”的选择,调配出怎样风格的威士忌推出市场,何种风味的威士忌能够大卖才是商业化下的威士忌酒厂的首选,也是Master Blender team与销售团队按其市场理解所角力后互相妥协的结果。听落很难令人接受,但现实的确如此。 最后,你说威士忌的风土存不存在?存在啊,在人那里。 威士忌的风土重不重要?或许其重要性就如威士忌的颜色一般,大家可以盲品出威士忌的颜色吗? 单一麦芽威士忌的重点不就是讲求独一无二的个性吗?是不是大家都忘记了? Author:Mr Jeremy Whiskiology…
